2.3-Strength of Acid or Base Solutions
2.3-Strength of Acid or Base Solutions Important Formulae
You are currently studying
Grade 10 → Science → Acids, Bases and Salts → 2.3-Strength of Acid or Base Solutions
The strength of an acid or base solution refers to its ability to dissociate into ions in water. This property determines the solution's reactivity and its pH level, which is crucial in various chemical and biological processes.
2.3.1 Definition of Acid and Base Strength
- Strong Acids: Completely dissociate in water, releasing a high concentration of hydrogen ions (H+). Examples include:
- Hydrochloric acid (HCl)
- Sulfuric acid (H2SO4)
- Nitric acid (HNO3)
- Weak Acids: Partially dissociate in water, resulting in a lower concentration of hydrogen ions. Examples include:
- Acetic acid (CH3COOH)
- Citric acid (C6H8O7)
- Strong Bases: Completely dissociate in water, releasing a high concentration of hydroxide ions (OH-). Examples include:
- Sodium hydroxide (NaOH)
- Potassium hydroxide (KOH)
- Weak Bases: Partially dissociate in water, resulting in a lower concentration of hydroxide ions. Examples include:
- Ammonium hydroxide (NH4OH)
- Magnesium hydroxide (Mg(OH)2)
2.3.2 Measuring Strength: pH Scale
The pH scale is used to quantify the strength of acids and bases:
- The scale ranges from 0 to 14.
- Acidic solutions have a pH less than 7.
- Neutral solutions have a pH of 7.
- Basic solutions have a pH greater than 7.
- Strong acids have pH values closer to 0, while strong bases have pH values closer to 14.
2.3.3 Factors Affecting Acid and Base Strength
- Dissociation: The extent to which an acid or base dissociates in water determines its strength. Strong acids and bases dissociate completely, while weak acids and bases do not.
- Concentration: The concentration of an acid or base solution can affect its strength. A higher concentration of a strong acid will have a lower pH compared to a diluted version.
- Temperature: Temperature can influence the dissociation of acids and bases, potentially affecting their strength.
2.3.4 Examples of Acid and Base Strength
- Strong Acid Example: Hydrochloric acid (HCl) dissociates completely:
- HCl → H+ + Cl-
- Weak Acid Example: Acetic acid (CH3COOH) dissociates partially:
- CH3COOH ⇌ H+ + CH3COO-
- Strong Base Example: Sodium hydroxide (NaOH) dissociates completely:
- NaOH → Na+ + OH-
- Weak Base Example: Ammonium hydroxide (NH4OH) dissociates partially:
- NH4OH ⇌ NH4+ + OH-
2.3.5 Applications of Acid and Base Strength
Understanding the strength of acids and bases is crucial in various fields:
- Industrial Processes: Many chemical manufacturing processes depend on the strength of acids and bases.
- Biological Systems: The pH level is vital in biological processes, influencing enzyme activity and metabolic functions.
- Environmental Science: Monitoring pH levels in soil and water helps assess environmental health and pollution levels.
Chris Evans, CC0, via Wikimedia Commons
2.3-Strength of Acid or Base Solutions
जब हम किसी अम्ल (acid) या क्षार (base) की घोल की ताकत (strength) की बात करते हैं, तो इसका मतलब है कि उसमें हाइड्रोजन आयन ($H^+$) या हाइड्रॉक्साइड आयन ($OH^-$) की सांद्रता कितनी है। अधिक सांद्रता होने पर घोल अधिक मजबूत होता है।
अम्लों और क्षारों के घोल की ताकत को उनके गुणसूत्र (concentration) और उनकी संयोग (dissociation) की क्षमता के आधार पर मापा जाता है।
1. अम्ल की ताकत (Strength of Acid)
अम्ल की ताकत यह निर्धारित करती है कि अम्ल अपने आयनों में कितने प्रतिशत विचलित (dissociate) होता है। जब एक अम्ल पानी में घुलता है, तो वह हाइड्रोजन आयन ($H^+$) या हाइड्रोनियम आयन ($H_3O^+$) में बदलता है।
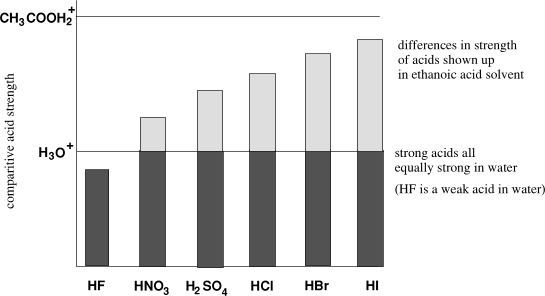
यदि कोई अम्ल पूरी तरह से विचलित हो जाता है, तो इसे मजबूत अम्ल (strong acid) कहा जाता है। जैसे कि हाइड्रोक्लोरिक अम्ल ($HCl$) और सल्फ्यूरिक अम्ल ($H_2SO_4$)।
यदि कोई अम्ल केवल आंशिक रूप से विचलित होता है, तो इसे कमजोर अम्ल (weak acid) कहा जाता है। जैसे कि एसीटिक अम्ल ($CH_3COOH$) और हाइड्रोफ्लोरिक अम्ल ($HF$)।
2. क्षार की ताकत (Strength of Base)
क्षार की ताकत यह निर्धारित करती है कि क्षार कितने प्रतिशत हाइड्रॉक्साइड आयन ($OH^-$) पैदा करता है जब वह पानी में घुलता है। जब एक क्षार पानी में घुलता है, तो वह हाइड्रॉक्साइड आयन ($OH^-$) उत्पन्न करता है।
अगर एक क्षार पूरी तरह से विचलित हो जाता है, तो इसे मजबूत क्षार (strong base) कहा जाता है। जैसे कि सोडियम हाइड्रॉक्साइड ($NaOH$) और पोटेशियम हाइड्रॉक्साइड ($KOH$)।
अगर एक क्षार केवल आंशिक रूप से विचलित होता है, तो इसे कमजोर क्षार (weak base) कहा जाता है। जैसे कि अमोनिया ($NH_3$)।
3. अम्ल या क्षार की सांद्रता और ताकत (Concentration and Strength of Acid or Base)
अम्ल या क्षार की ताकत और सांद्रता दो अलग-अलग बातें हैं। सांद्रता यह बताती है कि घोल में अम्ल या क्षार के अणु कितने हैं, जबकि ताकत यह बताती है कि इन अणुओं के द्वारा कितने हाइड्रोजन या हाइड्रॉक्साइड आयन पैदा किए जा रहे हैं।
सांद्रता अधिक होने पर, घोल में अधिक अम्ल या क्षार होते हैं, परंतु ताकत का निर्धारण यह देख कर किया जाता है कि वे आयन कितने उत्पन्न कर रहे हैं। उदाहरण के लिए, $0.1 M$ हाइड्रोक्लोरिक अम्ल एक मजबूत अम्ल है, जबकि $0.1 M$ एसीटिक अम्ल एक कमजोर अम्ल है।
4. pH स्केल (pH Scale)
अम्लीयता और क्षारीयता की ताकत को मापने के लिए pH स्केल का उपयोग किया जाता है। pH स्केल 0 से 14 तक होता है, जिसमें:
- pH $< 7$ वाले घोल अम्लीय होते हैं (Acidic solutions)
- pH $> 7$ वाले घोल क्षारीय होते हैं (Basic solutions)
- pH $= 7$ वाला घोल न्यूट्रल होता है (Neutral solution)
pH स्केल में कम pH का मतलब है अधिक अम्लीयता, और अधिक pH का मतलब है अधिक क्षारीयता।
5. Ammonia और Water के उदाहरण
अमोनिया ($NH_3$) एक कमजोर क्षार है क्योंकि यह पानी में पूरी तरह से विचलित नहीं होता, जबकि पानी ($H_2O$) भी एक बहुत कमजोर अम्ल और क्षार दोनों के रूप में कार्य करता है। पानी में $H_2O \rightleftharpoons H^+ + OH^-$ जैसी प्रतिक्रिया होती है, लेकिन यह प्रतिक्रिया बहुत सीमित होती है।
अम्ल और क्षार की ताकत का सही निर्धारण उनके आयन के उत्पन्न होने की क्षमता पर निर्भर करता है, जिससे यह घोल के गुणसूत्र और प्रकार को प्रभावित करता है।
