3.1-Laws of Chemical Combination
3.1-Laws of Chemical Combination Important Formulae
You are currently studying
Grade 9 → Science → Atoms and Molecules → 3.1-Laws of Chemical Combination
- Apply the Law of Conservation of Mass to determine the mass of elements in a mixture.
- Apply the Law of Constant Proportions to estimate the amount of elements required in a chemical substance and identify postulates of Dalton’s atomic theory.
3.1.1-Law of Conservation of Mass:
During a chemical reaction, the total mass of reactants will be equal to the total mass of the products. Mass can neither be created nor be destroyed in a chemical reaction.3.1.2-Law of Constant Proportions:
In a chemical reaction, compounds always contain the same elements present in definite proportional by mass irrespective of their source.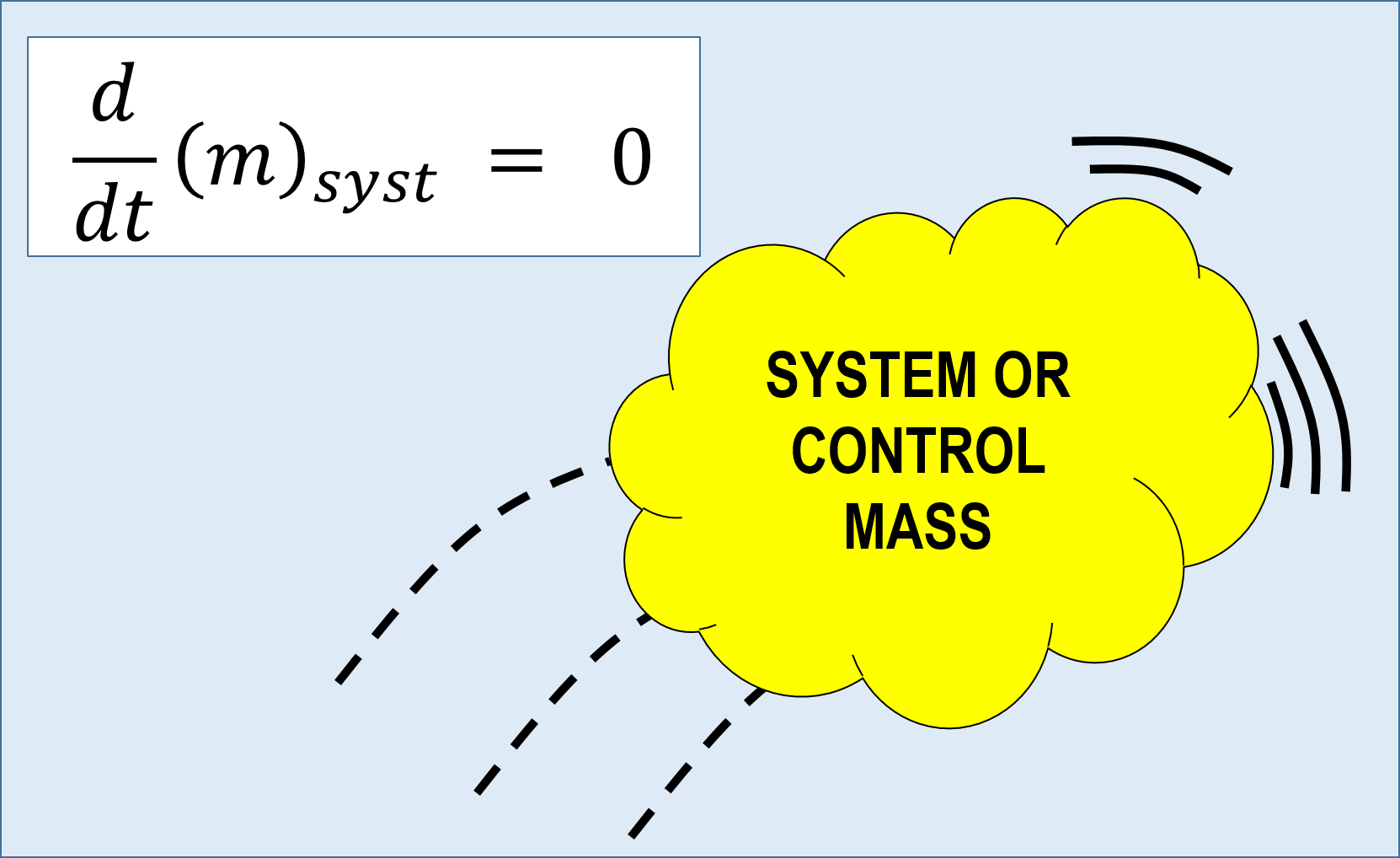
Joseasorrentino, CC BY-SA 4.0, via Wikimedia Commons
3.1 - Laws of Chemical Combination
रासायनिक संयोजन के नियम, रासायनिक प्रतिक्रियाओं के दौरान पदार्थों के संयोजन और वितरण के नियमों को व्यक्त करते हैं। इन नियमों का पालन रासायनिक प्रतिक्रियाओं के सही तरीके से होने के लिए आवश्यक है। रासायनिक संयोजन के मुख्य नियम निम्नलिखित हैं:
1. नियम-प्रारंभिक द्रव्यमान का संरक्षण (Law of Conservation of Mass)
इस नियम के अनुसार, किसी भी रासायनिक प्रतिक्रिया में कुल द्रव्यमान पहले और बाद में समान रहता है। यानी कि किसी रासायनिक प्रतिक्रिया में जो पदार्थ प्रतिक्रियाशील होते हैं, उनका कुल द्रव्यमान उत्पादों के द्रव्यमान के बराबर होता है।
उदाहरण के लिए:
यदि 10 ग्राम पोटेशियम क्लोराइड (KCl) और 5 ग्राम सोडियम (Na) एक साथ प्रतिक्रिया करते हैं, तो प्रतिक्रिया के बाद प्राप्त उत्पादों का कुल द्रव्यमान 15 ग्राम होगा।
2. निश्चित अनुपात का नियम (Law of Definite Proportions)
यह नियम कहता है कि किसी भी रासायनिक यौगिक में तत्व हमेशा एक निश्चित अनुपात में रहते हैं। इसका मतलब है कि कोई भी यौगिक अपनी संरचना में तत्वों के ही निश्चित अनुपात से बनता है।
उदाहरण के लिए, जल (H2O) हमेशा हाइड्रोजन और ऑक्सीजन के 2:1 के अनुपात में ही बना होता है।
3. बहुपद अनुपात का नियम (Law of Multiple Proportions)
इस नियम के अनुसार, यदि दो तत्व विभिन्न यौगिकों में मिलकर दो या अधिक यौगिकों का निर्माण करते हैं, तो इन तत्वों के बीच का अनुपात सरल और छोटे पूर्णांकों में होता है।
उदाहरण के लिए, कार्बन और ऑक्सीजन दो यौगिक बनाते हैं - कार्बन डाइऑक्साइड (CO2) और कार्बन मोनोऑक्साइड (CO). इन यौगिकों में कार्बन और ऑक्सीजन का अनुपात 1:2 (CO2 में) और 1:1 (CO में) होता है।
4. अवशोषण के नियम (Gay-Lussac's Law of Gaseous Volumes)
यह नियम कहता है कि जब गैसों के मात्राओं की प्रतिक्रिया होती है, तो उत्पादों की गैसीय मात्रा और प्रतिक्रियाशील गैसों की मात्राएं एक निश्चित अनुपात में होती हैं। यह अनुपात सामान्य ताप और दबाव पर देखा जा सकता है।
उदाहरण के लिए, 2 वॉल्यूम हाइड्रोजन (H2) और 1 वॉल्यूम ऑक्सीजन (O2) मिलकर 2 वॉल्यूम जल वाष्प (H2O) का निर्माण करते हैं।
5. आवेश का संरक्षण (Law of Conservation of Charge)
इस नियम के अनुसार, किसी रासायनिक प्रतिक्रिया में कुल आवेश (charge) पहले और बाद में समान रहता है। यह नियम परमाणुओं में इलेक्ट्रॉनों के आदान-प्रदान को समझाने में मदद करता है।
रासायनिक संयोजन के नियमों के उपयोग:
रासायनिक संयोजन के ये नियम रासायनिक प्रतिक्रियाओं को समझने में अत्यंत महत्वपूर्ण होते हैं। ये नियम यह निर्धारित करने में मदद करते हैं कि तत्वों के बीच कैसे और क्यों यौगिक बनते हैं, और उत्पादों की संरचना के बारे में जानकारी प्रदान करते हैं।
महत्वपूर्ण सूत्र:
नियमों के संदर्भ में कुछ महत्वपूर्ण सूत्र निम्नलिखित हैं:
- कुल द्रव्यमान का संरक्षण: $m_{\text{reactants}} = m_{\text{products}}$
- निश्चित अनुपात का नियम: यदि A और B तत्व मिलकर यौगिक X बनाते हैं, तो A और B का अनुपात हमेशा समान रहता है।
- बहुपद अनुपात का नियम: यदि A और B दो यौगिकों Y1 और Y2 का निर्माण करते हैं, तो A और B का अनुपात Y1 और Y2 में अलग-अलग पूर्णांकों में होगा।
